HE染色反蓝的原理:苏木素染液,细胞核内的染色质主要是去氧核糖核酸(DNA),DNA的双螺旋结构中,两条链上的磷酸基向外,带负电荷,呈酸性,很容易与带正电荷的苏木素精碱性染料以离子或氢键结合而被染色。苏木精在碱性溶液中呈蓝色,所以细胞核被染成蓝色。 分化:苏木素染色之后,用水洗去未结合在细胞上的染液,但是在细胞核中结合过多的染料和细胞浆中吸附的染料必须用分化液1%盐酸酒精脱去,才能保证细胞核和细胞浆染色的分明,把这个过程称为染色的分化作用。因酸能破坏苏木素的醌型结构,使色素与组织解离,分化不可过度。蓝化:分化之后苏木素在酸性条件下处于红色离子状态,在碱性条件下处于蓝色离子状态,而呈蓝色,所以分化之后用水洗去酸而中止分化,再用弱碱性水使苏木精染上的细胞核变呈蓝色,称蓝化作用,一般多用自来水浸洗即可变蓝,也可用温水(50度温水比较好)变蓝。HE染色(脱蜡、水化、染色、脱水、封片) - 实验方法。山东病理HE染色外包

HE染色注意事项:1.组织切片的脱蜡步骤应彻底,否则无论进行那种染色都会发生困难。脱蜡时间要充分,若溶蜡剂使用过久应及时更换以免效率降低,若室温过低,可将溶蜡剂置于温箱中进行脱蜡。 2.苏木素染液使用一段时间后表面易出现亮晶状飘浮物,这可能是液体表面的过氧化物,必须过滤除去,以防沉渣污染组织切片。苏木素液一般染过三、四百张切片后,着色力会减弱,着色不鲜艳,呈灰蓝色时应及时更换新液。 3.染色的时间长短需依据:染剂对组织的染色作用,室温条件,切片厚薄,固定液的类别,染液的新旧而进行调节。所以在染色时必须使用显微镜观察染色程度以利掌握时间。 4.分化十分重要。分化步骤的准确也是染色成败的关键,若分化失当则必然引起染色不匀或过淡,过深等现象,因此分化后一定要镜检,观察胞核是否清晰,胞浆呈淡白色。否则需再次分化,不然一旦复染后,组织会呈紫蓝色即“蓝盖红”现象。 5.还原液不宜过浓,若碱性太强易使组织脱落故以淡为宜。 6.伊红宜淡染,复染过深胞核会不清晰,影响镜检。 福建病理HE染色多少钱HE染色需要哪些材料及实验步骤。
HE染色常见问题:Q5:细胞核呈棕红色改变答:苏木素染液过度氧化;或苏木素染色后反蓝不足导致。应该立即更换苏木素染色液。或在流动自来水(一般自来水PH7.5-7.8),或在稀释的氨水溶液,或在0.2%碳酸氢钠中适当浸泡,这些步骤均可一定程度地加强苏木素染色后的反蓝效果。Q6:伊红染色较淡答:伊红的PH改变了(PH可能已大于5);或反蓝液体未漂洗干净,残留后影响胞浆嗜酸性染色;或者切片太薄并且在随后的脱水步骤停留过久。对策:检查伊红染色液PH,可采用乙酸调至4.6-5.0。根据以上提示,调整实验步骤。
HE染色骨组织的处理方式:组织里存有钙盐可妨碍用常规方法制作良好切片。骨组织及钙化病灶,经过固定后,需要先将钙盐除去使组织软化,才能进行常规切片。如果脱钙不全,则切片容易撕开或碎裂,损伤切片刀刀刃。脱去钙盐的过程,称为脱钙。骨组织固定24小时后,锯下不超过0.5cm厚的薄骨片,以4%甲醛溶液固定后,进行脱钙。骨组织过厚则需延长脱钙时间,但长时间浸于强酸会影响切片染色效果。取材骨组织固定于10%甲醛溶液24小时后再锯取厚度约0.5cm骨片固定以10%甲醛溶液固定2天脱钙将组织置于脱钙剂中,每日更换新鲜液,直至组织软化为止除酸流水冲洗24小时脱水、浸蜡、切片进行常规脱水、透明、浸蜡、切片南京英瀚斯,专业的病理染色实验服务平台。HE染色取材和样本保存方式。
HE染色细胞核灰蓝原因:(1)组织处理温度过高、过热,在石蜡停留的时间过长;(2)固定时间太短,接下来就直接在高浓度的乙醇中行脱水处理。对策:理论上来说,加热处理*在组织浸蜡步骤才使用,组织不能在热的蜡液中停留过长时间。如果由于某些原因不能进行下步包埋处理,完成浸蜡处理后的组织,可将组织连同塑料包埋盒一并放置在室温空气中,冷却凝固,以备包埋。待需要包埋时再重新加温直至石蜡融化即可。组织在处理前必须确保固定良好,脱水比较好能从低浓度的乙醇开始。骨组织HE染色的操作流程。福建病理HE染色多少钱
HE染色原理 试剂 染色步骤 注意事项 。山东病理HE染色外包
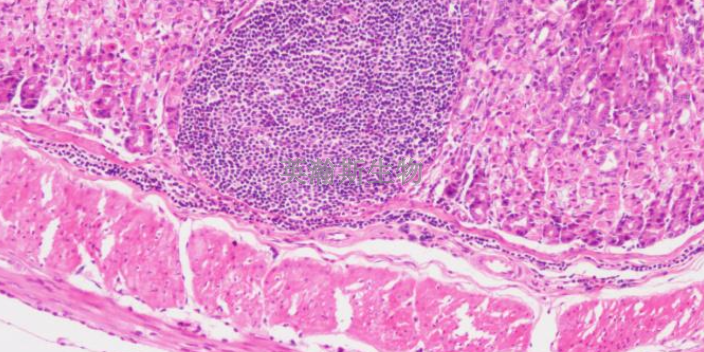
HE染色在**染色中的应用,小细胞肺*是肺*中分化程度比较低、恶性程度比较高的一种恶性**,生长迅速,转移较早,五年存活率*为1%-2%,预后非常差。其小细胞肺***细胞HE染色的特征,主要表现为组织结构,包括巢状、小梁状、实性片状,常有菊形团形成,*巢周围的瘤细胞呈栅栏状排列,*细胞较小,一般小于三个静止的淋巴细胞,呈圆形、卵圆形或短梭形,胞质稀少,胞界不清,核染色质呈细颗粒状,核仁缺乏或不明显,核分裂象每十个高倍视野大于十一个,常见大片状坏死。山东病理HE染色外包